Instruks
Formål:
At beskrive udredning og behandling af Paraneoplastiske Neurologiske Syndromer.
Baggrund:
Paraneoplastiske neurologiske syndromer har tidligere været anvendt om neurologiske syndromer med særlige kliniske fænotyper (f.eks. limbisk encefalitis eller subakut cerebellar degeneration) med samtidig forekomst af autoantistoffer rettet mod intracellulære antigener (f.eks. anti-Hu).
Den anvendte terminologi på området er ikke retvisende, da de paraneoplastiske encefalitter i sagens natur er autoimmune, og de autoimmune encefalitter ikke sjældent er paraneoplastiske. Man har derfor for nyligt ændret de diagnostiske kriterier.
Klassifikation:
I de opdaterede diagnostiske kriterier deler man paraneoplastiske neurologiske syndromer i høj og intermediær risiko fænotyper.
Høj-risiko neurologiske fænotyper, blev tidligere benævnt ”klassiske” paraneoplastiske neurologiske syndromer, og omfatter i) encefalomyelitis, ii) limbisk encefalitis, iii) hurtig progredierende cerebellart syndrom, iv) opsoklonus-myoklonus syndrom, v) sensorisk neuropati/neuronopati, vi) enterisk neuropati (gastrointestinal pseudo-obstruktion) samt vii) Lambert-Eaton myastent syndrom.
Fælles for disse kliniske fænotyper er, at cancer er en vigtig udløsende faktor, og derfor skal patienterne altid udredes for en underliggende cancer.
Intermediær-risiko neurologiske fænotyper er karakteriseret ved, at relationen mellem klinik og autoantistoffer er erkendt, men er mindre pålidelig. De neurologiske syndromer i denne gruppe kan altså ses både med og uden underliggende cancer. Paraneoplastiske neurologiske syndromer skal især overvejes, hvis symptomerne progredierer hurtigt.
Fænotyperne er: i) Hjernestamme-encefalitis, ii) isoleret myelopati, iii) polyradikulitis, iv) Stiff-Person Spectrum Disorder samt v) Morvans syndrom.
Tabel 1: Risiko fænotyper ved paraneoplastiske neurologiske syndromer:
HØJRISIKO FÆNOTYPER |
|
Encefalomyelitis |
Bruges om tilstande, hvor der findes kliniske tegn på affektion af det centrale nervesystem flere steder, og hvor der også kan være involvering af det perifere nervesystem. Dette kunne eksempelvis være encefalomyelitis med perifer neuropati eller subakut sensorisk neuronopati. |
Limbisk encefalitis |
Hurtigt progredierende (mindre end 3 mdr.) hukommelsesbevær, psykiatriske manifestationer og epileptiske anfald. Debut kan ligne f.eks. herpes simplex encefalitis. |
Hurtigt progredierende cerebellart syndrom |
Tilstanden blev tidligere benævnt subakut cerebellar degeneration og dækker over klinisk hurtigt udviklende cerebellar dysfunktion med både trunkal- og ekstremitetsataksi. Tilstanden medfører oftest en hurtig påvirkning af dagligdagsaktiviteter funktioner. |
Opsoklonus-myoklonus syndrom |
Der ses kaotiske irregulære multidirektionelle sakkader uden intersakkadeinterval kombineret med aktionsmyoklonus på krop, ekstremiteter og hoved. Tilstanden kan være ledsaget af cerebellare og encefalopatiske symptomer. |
Sensorisk neuronopati |
Hastigt progredierende sensoriske forstyrrelser medførende svær sensorisk ataksi og ofte pseudoathetose. |
Gastrointestinal pseudoobstruktion |
Skyldes inflammation i plexus myentericus. Det viser sig ved gentagne episoder med abdominalsmerter, obstipation til tider med opkastning. Der findes ikke tegn på mekanisk obstruktion. Tilstanden er ofte kombineret med sensorisk neuronopati eller encefalomyelitis. |
Lambert Eatons Myastene Syndrom |
Viser sig med proksimal muskelsvaghed og starter ofte med affektion i underekstremiteterne med efterfølgende spredning til overekstremiteter, derefter tilkommer affektion af bulbære funktioner (dysartri og dysfagi) og øjenmuskulatur. Hos de fleste er der en betydelig autonom dysfunktion med mundtørhed og erektil dysfunktion. Klinisk findes manglende senereflekser, som dog kan fremkaldes efter gentagne muskelkontraktioner. |
INTERMEDIÆR-RISIKO FÆNOTYPER |
|
Hjernestammeencefalitis |
Debuterer ofte med øjenmuskelsymptomer og bulbær affektion. Tilstanden kan være ledsaget af cerebellare symptomer, bevægeforstyrrelser og diencefale symptomer (f.eks. narkolepsi eller hypertermi m.fl.). |
Isoleret myelopati |
Påvises som en ofte langstrakt medullær affektion af grå og/eller hvid substans med ledsagende medullære symptomer. |
Polyradikulitis |
Viser sig i reglen med samtidig CNS affektion og har et aksonalt præg. Symptomerne kan være symmetriske eller asymmetriske, og forekomsten af neurogene smerter og dysautonomi er varierende. |
Stiff-person syndrom |
Stiff-person syndrome er en sjælden manifestation, hvor der er kontinuerlig muskelaktivitet. Dette viser sig som smertefulde muskelspasmer ofte med påvirket gang og hyperlordose. Muskelspasmerne forværres ved aktivitet eller eksterne stimuli. Som ved enkelte paraneoplastiske neurologiske syndromer er der ofte mere involvering af overekstremiteter og nakke end resterende muskulatur. |
Morvans syndrom |
Defineres som perifer nerve hypereksitabilitet med encefalopati. Sidstnævnte er karakteriseret ved adfærdsændring, hallucinationer, dysautonomi og søvnforstyrrelse (som oftest agrypnia excitata). |
Association med autoantistoffer:
Neurale autoantistoffer er vigtige for at målrette udredningen for en underliggende cancer. Termen ”onkoneurale antistoffer” anvendes ikke, men er erstattet af ”høj risiko” autoantistoffer (>70% association til cancer) og intermediær risiko autoantistoffer (30-70% association til cancer) og lav-risiko autoantistoffer, hvor der er <30% association til cancer (Tabel 2).
Tabel 2: Oversigt over antistoffer, fænotyper og underliggende malignitet
AUTOANTISTOF |
NEUROLOGISK FÆNOTYPE |
HYPPIGSTE TUMORFUND |
HØJ RISIKO |
>70% RISIKO |
|
Hu (ANNA-1) |
Sensorisk neuronopati, pseudoobstruktion, encefalomyelitis, limbisk encefalitis |
SCLC, neuroendrokrin tumor, neuroblastom |
CV2/CRMP5 |
Encefalomyelitis, sensorisk neuronopati |
SCLC, thymom |
SOX1 |
Lambert Eaton, cerebellar dysfunktion |
SCLC |
PCA2 (MAP1B) |
Sensoromotorisk neuropati, cerebellar dysfunktion, encefalomyelitis |
SCLC, NSCLC, c. mammae |
Amfifycin |
Polyradikuloneuropati, sensorisk neuronopati, encefalomyelitis, Stiff-person syndrome |
SCLC, c. mammae |
Ri (ANNA-2) |
Hjernestamme syndrom og cerebellar dysfunktion. Opsoklonus-myoklonus |
C. mammae, SCLC, NSCLS |
Yo (PCA-1) |
Progressiv cerebellar dysfunktion |
C. ovarii og c. mammae |
Ma2 |
Limbisk encefalitis, diencefal dysfunktion, hjernestamme encefalitis |
Testis cancer og NSCLC |
Tr (DNER) |
Progressiv cerebellar dysfunktion |
Hodgkins lymfom |
KLHL11 |
Hjernestamme og cerebellar dysfunktion |
Testis cancer |
INTERMEDIÆR RISIKO |
30-50% RISIKO |
|
AMPAR |
Limbisk encefalitis |
SCLC, thymom |
GABABR |
Limbisk encefalitis |
SCLC |
mGluR5 |
Encefalitis |
Hodgkins lymfom |
P/Q VGCC |
Lambert Eaton myastent syndrom |
SCLC |
NMDAR |
Anti-NMDAR encefalitis |
Ovarieteratom eller andet teratom |
Caspr2* |
Morvans syndrom |
Thymom |
LAV RISIKO |
||
mGluR1 |
Cerebellar ataksi |
Hæmatologisk |
GABAAR |
Encefalitis |
Thymom |
Caspr2 |
Limbisk encefalitis, Neuromyotoni (Isaac syndrom) |
Thymom |
GFAP |
Meningoencefalitis |
Ovarieteratom, adenokarcinom |
GAD65 |
Limbisk encefalitis, Stiff-person syndrom, cerebellar ataksi |
SCLC, neuroendokrin tumor, thymom |
LGI1 |
Limbisk encefalitis |
Thymom, neuroendokrin tumor |
DPPX |
Encefalitis med hypereksitabilitet, PERM |
B-celle neoplasi |
GlyR |
Limbisk encefalitis, PERM |
Malignt thymom, Hodgkins lymfom |
*Caspr2 er kun intermediær risiko ved Morvan syndrom.
Forkortelser: AMPAR: alfa-amino-3-hydroxy-5-methyl-4-isoxazoleproprionic acid receptor; ANNA: antineuronal nuclear antibody; Caspr2: contactin-associated perotein like 2; CRMP5: collapsing response-mediator protein 5: DNER: delta/notch-like epidermal growth factor-related receptor; DPPX: dipeptidyl peptidase-like protein: GABA: gamma-amino-buturic acid; GAD65: Glutamic acid decarboxylase 65kDa; GlyR: Glycine receptor: LGI1: Leucine-rich Glioma Inactivated 1; KLHL11: Klech-like protein 11; MAP1B: Microtubule associated protein 1B; mGluR: metabotropic glutamate receptor; NMDAR: N-Methyl-D-Aspartat receptor; PCA purkinje cell antibody; NSCLC: Ikke småcellet lungecancer: PERM: Progressiv encefalomyelitis med rigiditet og myoclonus: VGCC: Valtage-gated calcium channel. SCLC: Små-cellet lunge cancer.
Modificeret fra Graus et al., Neurol Neuroimmunol Neuroinflamm. 2021 May 18;8(4):e1014.
Diagnostiske kriterier:
Kombinationen af klinisk fænotype, autoantistof, tilstedeværelse eller fravær af cancer og opfølgningsperiode anvendes til beregning af Paraneoplastisk Syndrom-Care score, som kan sandsynliggøre forekomsten af paraneoplastiske neurologiske syndromer (Tabel 3). Ved hjælp af denne score, kan et paraneoplastisk neurologisk syndrom hos den enkelte patient graderes som definitiv, sandsynlighed eller mulig. Man skal være opmærksom på, at anvendelse af Paraneoplastisk Syndrom-Care score, kan underestimere forekomsten af såkaldt seronegativ paraneoplastisk neurologisk syndrom, dvs. et paraneoplastisk neurologisk syndrom, hvor der ikke kan påvises et neuralt autoantistof i serum eller cerebrospinalvæske.
Tabel 3: Paraneoplastisk neurologisk syndrom-care score
Point |
|
Klinisk niveau |
|
Høj-risiko fænotyper |
3 |
Intermediær-risiko fænotyper |
2 |
Fænotype ikke associeret med øget cancer risiko |
0 |
Laboratorie niveau |
|
Høj-risiko antistoffer |
3 |
Intermediær-risiko antistoffer |
2 |
Lav risiko antistoffer |
0 |
Cancer |
|
Påvist. Stemmer overens med antistoftype (hvis fundet), eller antigenet fundet udtrykt i patologisvar af tumorvæv |
4 |
Ikke påvist under 1.udredning, eller stemmer ikke overens med antistoftype, men fundet ved opfølgning
| 1 |
Ikke påvist, ej heller ved opfølgning
| 0 |
Diagnostisk niveau |
|
Definitiv |
> 8 |
Sandsynlig |
6-7 |
Mulig |
4-5 |
Ikke paraneoplastisk neurologisk syndrom |
Modificeret fra Graus F, et al. Neurol Neuroimmunol Neuroinflamm. 2021 May18;8(4):e1014.
Udredning:
MR-C skanning: Bør laves med følgende sekvenser: T1, T1 med kontrast, T2, FLAIR, DWI og ADC. Der kan ses forandringer, som er beskrevet under de enkelte syndromer nedenfor. Det skal dog bemærkes, at MR-C skanningen kan være normal.
EEG: EEG viser ved paraneoplastisk limbisk encefalitis ofte iktal eller lavfrekvent aktivitet i temporalregionen uni- eller bilateralt.
Neurofysiologi:
EMG og ENG kan være indiceret ved mistanke om affektion af det perifere nervesystem.
Autoantistoffer:
Både blod og CSV undersøges.
Udredning for malignitet: Typen af antistof er mere end det kliniske syndrom bestemmende for risiko og type af underliggende malignitet.
tumor |
Screeningsundersøgelse |
Små cellet lunge carcinom |
CT thorax evt. efterfulgt af FDG-PET eller PET-CT |
Tymom |
CT thorax evt. efterfulgt af FDG-PET eller PET-CT |
Brystcancer |
Mammografi, hvis negativ FDG-PET |
Ovarieteratom |
Transvaginal ultralyd og CT/MR af abdomen, hvis negativ CT thorax |
Ovariecarcinom |
Transvaginal ultralyd og CA-125, efterfulgt af CT af pelvis og abdomen eller PET-CT |
Testiscancer |
Ultralydsskanning, beta-HCG og alfa-føtoprotein efterfulgt af CT af bækkenet. Hvis mikrokalcifikationer på ultralydsskanning og alder under 50 år anbefales biopsi |
*I praksis anses FDG-PET som mere sensitiv end CT, hvorfor denne oftest foretrækkes som primære udredning.
Intet antistof, men høj-risiko fænotype:
Hvis man ikke finder autoantistoffer hos en patient med klassisk paraneoplastisk neurologisk syndrom,
screenes efter den mest sandsynlige underliggende tumor (se ovenfor). Hvis denne screening er
negativ, anbefales helkrops FDG-PET.
Hvis der ikke kan påvises en underliggende cancer:
Hvis screeningen er negativ hos patienter med paraneoplastisk neurologisk syndrom og høj-risiko
antistoffer, anbefales screeningsundersøgelse (se ovenfor) gentaget efter 3 måneder og som udgangspunkt herefter hver 6. måned i 4 år.
Andre relevante undersøgelser:
Hvis relevant bør det overvejes at udrede med hjerne FDG-PET, neuropsykologi, differential diagnostiske tests (f.eks. ANCA ved mistanke om vaskulitis, udredning for HIV, syfilis, LDH ved mistanke om lymfom eller intravaskulært lymfom, TSH samt metaboliske tests).
Behandling:
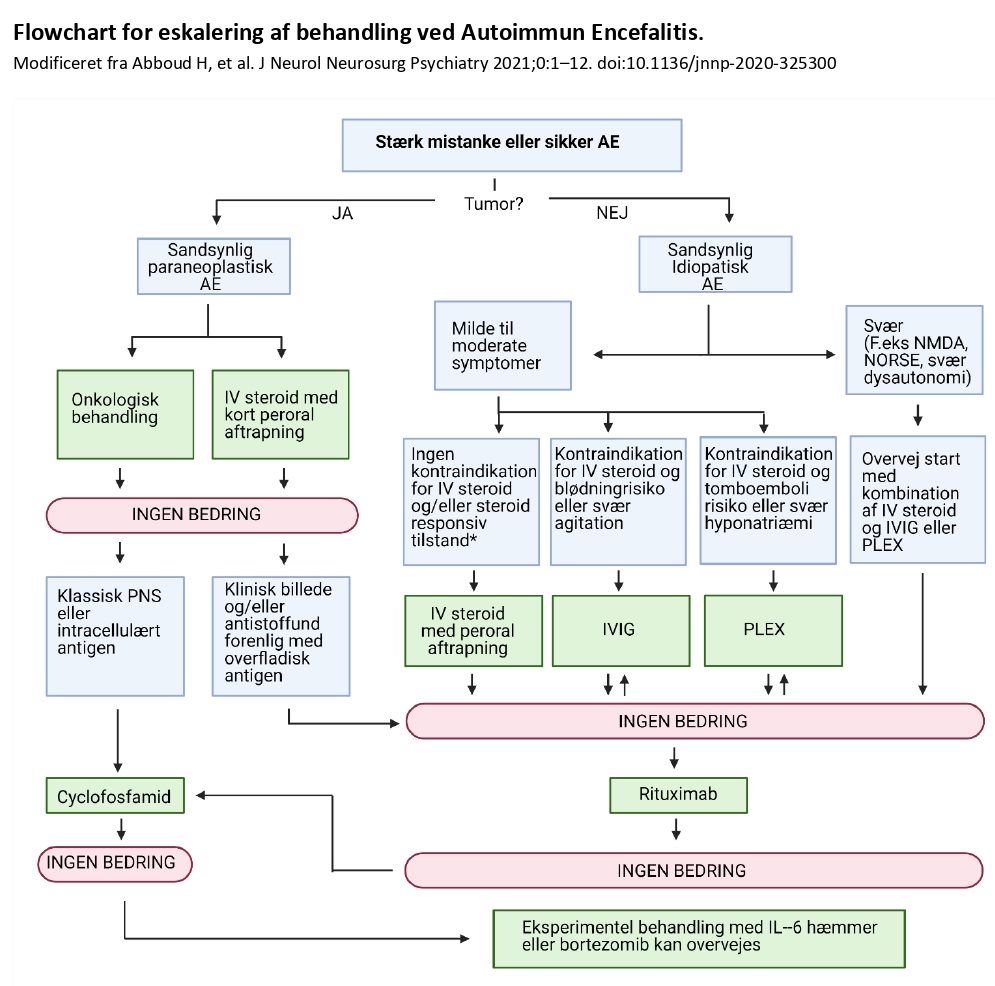
Figur: Steroid-responsive tilstande inkluderer faciobrachiale dystone anfald (FBDS), som ses ved anti-LGI1 encefalitis, autoimmun encefalitis under behandling med immun check-point inhibitorer, central demyelinisering, autoimmun anti-GFAP astrocytopati, chronic lymphocytic inflammation withg pontine perivascular enhancement responsive to steroids (CLIPPERS) og steroid responsiv encefalopati associeret med autoimmun thyroiditis (SREAT – Tidligere Hashimotos encefalopati).
Relative kontraindikationer til steroid inkluderer ukontrolleret hypertension, ukontrolleret diabetes, akut mavesår eller svære adfærdsforstyrrelser, som forværres af steroidbehandling. Høj tromboembolisk risiko inkluderer patienter med kendt eller mistænkt cancersygdom, rygning, hypertension, diabetes, hyperlipidæmi og hyperkoagulable tilstande.
LGI1: Leucine-rich Glioma Inactivated 1; GFAP: Glial Fibrillary Acidic Protein; NORSE: New Onset Refractory Status Epilepticus; PNS: Paraneoplastisk Neurologisk Syndrom.
Modificeret fra: Abboud H, et al. J Neurol Neurosurg Psychiatry 2021;0:1–12. doi:10.1136/jnnp-2020-325300
Onkologisk behandling:
Vigtigste prognostiske faktor er opsporing og behandling af underliggende cancer. Fjernelsen af svulsten, hvis muligt, er den vigtigste prognostiske faktor for patientens morbiditet og restlevetid.
Immunterapi:
Der er ingen sikker evidens for behandling med plasmaferese eller immunglobulin. Der findes dog kasuistiske beskrivelser, hvor behandlingseffekten har været god. Denne behandling kan også anvendes, hvis påviste antistof er rettet mod overflade antigener, hvor behandlingen har en mulighed for at kunne virke i modsætning til ved intracellulære antigener.
Følgende algoritmer kan anvendes:
1) Højdosis binyrebarkhormon (Methylprednisolon 1g iv i 5 dage) med peroral aftrapning.
Hvis ingen effekt heraf kan overvejes:
2) Intravenøs cyklofosfamid (750mg/m2) hver måned i 6 måneder eller tablet cyklofosfamid (2-3 mg/kg/dag)
Senest revideret: 17. august 2022
Forfattere: Morten Blaabjerg og Camilla Mærsk-Møller
Referenter: Daniel Kondziella og Henrik Boye Jensen
Godkendt af: NN, redaktionsgruppe E
